La GH
La GH est produite dans les cellules somatotropes de l'adénohypophyse.
C'est une protéine globulaire de 191 AA (chez l'homme), contenant 2 ponts dissulfures entre les Cystéines 53 et 165 (grande boucle)
et 182 et 189 (petite boucle). Ces ponts dissulfures sont intrachaines. La hGH va dans le sang sous forme non glycosylée (22 kD).
Lors de la synthèse de la GH, une variante est aussi synthètisée (environ 10%), il s'agit de la GH bregma. C'est une molécule délétée de 15 AA (de 32 à 46) par rapport à la GH.
Cette protéine de 20kD module les effets prolifératifs de la GH 22kD.
Il existe une autre fome de GH, synthètisée lors de la gestation au niveau du placenta, appelée la GH placentaire ou Syncitiotrophoblaste ou GHv (22kD).
La GHv intervient dans le maintien du developpement embryonaire.
La hGH est constituée de 4 hélices alpha connectées par des ségments flexibles primordiaux pour la fixation au récepteur.
La hGH a 2 sites de fixation au récepteur, le site 1 à une forte affinité et le site 2 spécifique.
Le recepteur GH forme un dimère.
Le gène de la Gh se situe sur le bras q du chromosome 17 (bras long). Il fait 2 kbases de long (promoteur, 4 intros et 5 exons).
Le gène hGH est régulé par des facteurs:
- GHF1 ou Pit1. Ce facteur n'est présent que dans les cellules somatrotropes hypophysaires.
Pit1 est une protéine à doigt de zinc (protéine à homéobox) se fixant sur une séquence palindromique du promoteur. Pit1 régule ainsi la transcription du gène de la hGH.
- la GRF (ou GHRH): facteur hypothalamique activant via un recepteur à protéine G une phosphorylase (PKA) qui va stimuler la transcription.
- les glucocorticoïdes: qui se fixe sur l'ADN et stimule la transcription.
- La T3: se fixe sur des récepteurs nucléaires et active la transcription.
La régulation de sécrétion de la hGH
Production et rythme
Sécrétée différent selon les espèces et les sexes mais toujours de façon pulsatile par l'adénohypophyse. Il y a un pic de GH toutes les 3/4 heures.
Chez l'homme : hypersécrétion nocturne, arrêt des sécrétion après un pic et sécrétion aprés les repas.
Chez la femme : il y a plus de pics de sécrétion mais à amplitude plus faibles. La même quantité de GH est sécrété par l'homme et la femme par jour.
Ces différences déterminent les phénotypes liés au sexe. Ces différences agissent au niveau des muscles, des os, des tissus adipeux et des organes induisant les caractères sexuels secondaires.
A 60 ans on ne produit plus que 20% de la quantité sécrétée à 18 ans (= somatopose).
Régulation
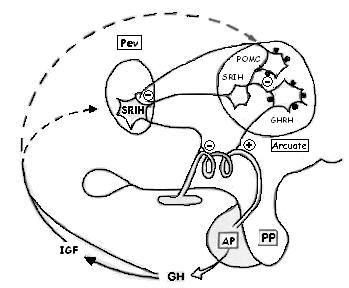 |
Facteurs hypothalamique :
- GRF : peptide de 44 AA produit par les noyaux arqués, agissant sur les récepteurs à GRF (protéine G) des cellules somatotropes.
GRF --> R.GRF --> Pt G (stimulation) --> IP3/DAG --> entrée de Ca2+ --> libération de vésicules de GH par les cellules dans la circulation.
De plus GRF agit sur le gène de la GH et induit sa synthèse.
- SRIF (somatotropin releasing inhibiting factor) : synthétisé au niveau du pancréas et surtout des noyaux paraventriculaires (éminence médiane). Peptide de 14 ou 28 AA agissant sur les cellules somatotropes via le système porte H-H. Recepteur SRIF est couplé à une Ptn G inhibitrice qui bloque l'entrée de Ca2+ et ainsi la libération de GH. |
La pulsatilité est la compitivité entre la GRF et la somatostatine.
Les pics sont l'activation des neurones à GRF.
Les latences sont l'activation des neurones à SRIF.
- IGF 1 (somatomédine) : GH induit la libération de IGF1 qui est produite par le foie, (un rôle dans la prolifération et la différenciation cellulaire) et agit sur les noyaux à somatostatine (Feed back -).
La GH exerce un feedback - sur sa production et sa libération.
La synthèse de la GH est stimulée par:
-facteurs centraux : dopamine, sérotonine, adrénaline, acétylcholine.
-facteurs hormonaux : oestrogènes, androgènes, T3, glucagon.
-facteurs humoraux : AA.
-facteurs exogènes : exercice physique, stress, sommeil, hypoglycémie...
L'inhibition de la synthèse de la GH peut être due à l'hyperglycémie, l'obésité, l'hyperthyroidie...
Transport et internalisation
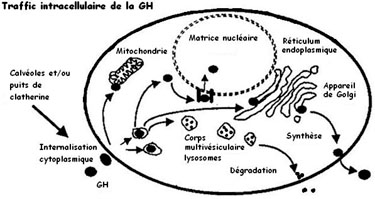 |
A sa libération dans le sang, la GH est liée à un GHBP (GH binding protein) et est libérée au niveau de cellules cibles ayant des RGH (GHPB augmente la 1/2 vie de l'hormone transportée).
Une fois fixé à son R, le complexe Ho-R est internalisé par des vésicules clathrinées ou cavéolées puis la vésicule est dégradée par des lysosymes. L'internalisation des récepteurs déssensibilise la cellule cible, ce qui baisse l'action hormonale.
Le complexe est distribué sur différents compartiments subcellulaires :
|
- GH au niveau de la matrice mitochondriale pour la régulation du stock d'énergie disponible.
- GH au niveau de la matrice nucléaire pour la régulation de gène.
- GH au niveau du RE et de l'ADG pour la resynthèse.
- GH est dégradée au niveau des reins et éliminée par les urines.
Actions de la GH
Métabolisme glucidique et lipidique
Tous les tissus de l'organisme expriment des récepteurs GH mais pas toutes les cellules. La GH a un effet de type pleiotrope.
2 types d'action sur le métabolisme glucidique et lipidique :
- Insulino-mimétique :
augmente le transport du glucose, des AA et de lipides (niveau des tissus adipeux), augmente la synthèse protéique
(production de protéines musculaires; augmentation des myofibrilles), formation de réserve de glycogène dans le foie et les muscles.
- Anti-insulino-mimétique : hyperglycémiant ( augmente le glc dans le sang = hormone diabétogéne),
activation des voies cataboliques du glycogène et glucidique (- de glucose formé, + de glycogène dégradé),
augmentation de la lipolyse (libération d'acides gras non estérifiés, captés par les cellules = energie = effet anabolisant).
Différenciation et prolifération cellulaire
Via la production de IGF1, la GH stimule la croissance tissulaire en activant les proto-oncogène Cmyc et Cfos (os, cartilage, tissus moux -coeur et viscères-).
Cmyc et Cfos sont des facteurs de transcription.
GH active la synyhèse de nombreux récepteurs et facteurs de croissance (GF) :
- R aux Epidermal Growth Factor (R.EGF) et EGF.
- NGFR (facteur de croissance nerveuse).
- R à prolactine (multiplication des glndes mammaires).
- R. aus oestrogènes et androgènes.
- R.IGF1 et IGF1
- R. à insuline
Action de la GH sur les tissus cibles
Tissus cibles |
Localisation Récepteurs GH |
Action de la GH (+ : stimulation / - : inhibition) |
| Les tissus adipeux |
dans les adipocytes et pré-adipocytes (non mature) |
Activation de la lipolyse
Induction différenciations pré-adipocytes.
rôle dans la progression adipeuse, la spécialisation adipeuse et dégradation lipidique. |
Les tissus osseux et cartilagineux |
cartilage sur les chondrocytes |
Hypertrophie, élargissement de l'épiphyse.
Synthèse locale d'IGF1 sur les chondrocytes |
| os sur les ostéoblastes |
Différenciation et prolifération (incorporation longitudinale des protéoglycanes, formation de la matrice osseuse).
Minéralisation de l'os (capture Ca2+ importante) |
Les tissus musculaire |
|
Augmente le nombre de fibres
Augmente la contractilité des fibres,
Induit la synthèse de protéines musculaires
Permet le transport de glucose ainsi que son oxydation pour le mécanisme de synthèse protéique.
Favorise la régénération musculaire |
Les tissus cardiaques |
|
Effet anabolisant (augmentation de la contractilité, du rythme, du débit, de la pression partielle, de la masse) |
Le système gastro-intestinal |
|
Capture et le transport des nutriments
Absorption d'eau et d'ions à travers les parois de l'intestin.
Equilibre hydro-minéral.
Induit la synthèse et la libération d'insuline (cellules béta-pancréatiques). |
Système reproducteur |
sur toutes les cellules du système reproducteur et des cellules de lignée germinatives |
Chez l'homme:
au niveau des cellules lignées germinales
induction de la spermatogènèse, du développement des organes génitaux.
Au niveau du tube séminifère, induction des R.LH sur les cellules de Leidzig et augmentation de la testostérone. |
Chez la femme :
diminution de l'artésie folliculaire (dégénérescence),
favorise l'ovulation,
la productiond'oestradiole par les cellules folliculaires,
la prolifération des cellules folliaires,
le synthèse de R.IGF et LH.
Au niveau de l'utérus, augmentation de la synthèse de R à oestradiole (différenciation endométre).
Au niveau des glandes mammaires, effet lactogène, augmentation de la vascularisation. |
La peau |
|
favorise la production de collagène et donc la prolifération des cellules épithéliales |
Les reins et surrénales |
partout sauf au niveau des glomérules |
réabsorption d'eau, Na+ (via IGF1)
augmente le taux de filtration glomérulaire
réabsorption du phosphate (équilibre acido-basique),
activation du système rénine-angiotropine,
inhibition du système ANF.
Au niveau des surrénales, activation de synthèse de cortisol et aldostérone (corticoïdes). |
Moëlle osseuse et thymus |
|
favorise l'érythropoïése. |
Le sytème nerveux central |
partout mais diminuent avec l'age |
Action sur les noyaux arqués et paraventriculaires qui contiennent les neurones à somatotropine et à GRF. Effets anti-apoptotique. |
système endocrinien |
cellules beta pancréatiques |
+ synthèse d'insuline |
| glandes surrénales |
+ corticoïdes |
| glande pinéale |
+ mélatonine |
| glandes sexuelles |
+ stéroïdes |
| thyroïde |
+ thymuline et - de T3/T4 |
L'hypophyse
effets paracrines |
cellules somatotropes |
feedback- |
| cellules lactotropes |
- synthèse PRL |
| cellules gonadotropes |
+ production LH-FSH |
Transduction du signal de la GH
GH Receptor et GHPB
- GHR : glycoprotéine de 130 kD contenant 1 domaine transmembranaire (20/30 AA), un autre cytoplasmique (350 AA) et un autre extracellulaire (250 AA).
Le domaine extracellulaire contient 3 ponts dissulfures., un site de N-glycosylation et un motif peptidique important pour la transduction (W-S-X-W-S soit tryptophane-sérine-(AA quelconque)-
tryptophane-sérine).
Le domaine intracellulaire contient lui aussi 2 sites importants pour la transduction (boite 1 et 2) ainsi qu'un résidu Tyrosine pouvant être phosphorylé activant une activité enzymatique.
Les R.GH sont regroupés en pool de récepteurs et peuvent être internalisés indépendemment de la présence de la GH. Le récepteur internalisé est toujours actif.
Ce récepteur est présent dés le stade 2 cellules de l'embryogènèse sensible à la sécrétion paracrine des blastocytes).
Le nombre de récepteur augmente de la naissance jusqu'à la puberté. Ces récepteurs sont régulés par l'insuline, les androgènes, les oestrogènes.
- GHPB : protèine de transport de la GH dans le sang (caractérisé dans le sérum, le placenta, le lait...).
Elle a une forte affinité pour la GH (5.108), elle fixe environ 50% des GH circulantes et les transportent jusqu'au cellules cibles en les protégeant.
La GHPB a une double origine : provient soit du clivage protéolytique d'un récepteur transmembranaire GH avec libération de la partie extracellulaire, soit d'un épissage alternetif donnant 2 ARNm (GHPB = 1 kb et GHR = 4 kb). Le foie est le plus gros producteur de GHPB.
Structure des R.GH
Les récepteurs à GH ont une forte homologie avec les récepteurs à Cytokine, à Prolactine et à Lectine. Ils utilisent la même voie de transduction du signal et appartiennet à la même superfamille.
Domaine transmembranaire
Domaine extracellulaire (homologie variable de 30/40% entre récepteurs de la superfamille), conservation des cystéines et du motif WS.
Domaine intracellulaire, contenant les boites 1 et 2 riche en tyrosine (fixe la Tyrosine Kinase JAK.
Ces récepteurs fonctionnent en DIMERE (homodimère ou hétérodimére, sous unité identiques ou différentes).
La GH a 2 sites de fixation, elle se fixe sur un premier récepteur ce qui en attire un deuxième et se fixe aussi(le deuxième site de fixation de la GH a moins d'affinité que le premier).
Cette fixation induit une transduction de signal intracellulaire.
GH et signalisation
Les cellules recevant la GH ont des récepteurs couplés à des protéines Kinases de type tyrosines Kinases (JAK = Janus Kinase).
3 voies de signalisation sont activées par l'activation de JAK2 : la voie MAP K via JAK, la voie JAK-STAT et la voie CAM Kinase.
- CAM Kinase pathway :
JAK2 active une protéine G couplé à une PIP3 Kinase(phospholipidase C) qui utilise
le Phosphoinositol-bi-phosphate = PIP2 (phospholipide membranaire) comme substrat. Le PIP2 devient alors DAG (diacylglycérol) et IP3 (inositol phosphate) qui sont 2 messagers intracellulaires.
IP3 va permettre l'entrée de Ca2+ dans la cellule (via des canaux ioniques Ca2+ IP3 dépendant). Le Ca2+ va se fixer sur la Calmoduline et la CAM Kinase (Protéine Kinase Ca2+/Calmoduline dépendante). La CAM K va phosphoryler des enzymes et des protéines activatrices de transcription.
DAG va activé une PKC nucléaire (protèine kinase C) qui va agir sur la différenciation cellulaire.
Donc la GH par la voie CAM K va activer le gène codant l' IRS (insuline receptor substrat) et des récepteurs à insuline vont se translocaliser vers la membrane plasmique.
- MAP Kinase pathway :
JAK2 phosphoryle une molécule (SHC), ce qui entraine une cascade enzymatique, qui in fine active MAPK et P90rsk. Ces 2 molécules s'internalisent dans la matrice nucléaire et phosphorylent des facteurs de transcription (TCF et SRF). Ces facteurs se fixent à la région SRE du gène c-fos.
- STAT pathway :
JAK2 s'autophosphoryle, phosphoryle les tyrosines du récepteur GH et active STAT 1, 3 et 5
(par phosphorylation bien entendu ;o). Cette activation des STAT mène à des changements de conformation et à une dimérisation (homodimère STAT5 et hétérodimère STAT1 et 3).
Les 2 molécules vont au niveau de la matrice nucléaire où STAT1-3 se fixe sur une région promotrice du gène c-fos (SIE) et STAT5-5 sur une région promotrice du gène Spi2.1 (GLE-1 : gamma like element). Spi1.2 code pour une protéase sérine inhibitrice.
EN RESUME :
C'est voies de signalisation peuvent être inhibées par :
- Des phosphatases (activité de déphosphorylation).Les phosphatases SHP et 2 vont déphosphoryler le R.GH et JAK2
- Compétitivité, les protéines JAB, SOCS et CIS vont se fixer sur les sites de STAT et JACK2 inhibant leurs activités.
Les IGF
Polypeptide hépatique produit par une stimulation de la GH. Les IGF ont un effet comme celui de l'insuline et mitogène.
Les IGF se fixent sur les R.IGF1 qui par activation de Tyrosines Kinases vont agir sur le gène IRS (effet métabolique).
IGF 1 agit sur la croissance et la différenciation des cellules musculaires et des chondrocytes (cartilage conjugué), et sur l'augmentation de la masse corporelle et la croissance.
IGF1 est modullé par IGF-PB : distribution tissulaire et protection, internalisation (inhibe la prolifération cellulaire), effets opposés à ce de IGF (antagoniste). La régulation se fait sur l'équilibre IGF / IGF-PB.
Physiopathologie de la GH et du RGH
GH
- Gigantisme et Acromégalie : un excés de GH avant la puberté provoque le gigantisme (augmentation rapide et non modulée de tous les ossements).
Un excés de GH après la puberté provoque l'acromégalie : épaississement des os du crâne, des mains, des cartilages, hypertrophie des v
iscères et du coeur, hypertrophie rénale et hépatique accompagné de nombreux troubles cardiaques (cardiomégalie), de déséquilibre hydrominéral
et acido-basique, d'intolérance au glucose (diabète aigu) et à la formation d'oedèmes.
Pour lutter contre celà : ablation de la tumeur hypophysaire et traitement avec des analogues de synthèse des molécules (somatostatine synthètique inhibant
la sécrétion de GH).
- Retard de croissance : un déficit de GH avant la puberté conduit au nanisme et après la puberté à l'augmentation des tissus adipeux et la diminution
des activité musculaires et cardiaques, os moux et diminution de la fertilité.
Pour palier à celà : via les techniques de génie génétique, injection de GH recombinée en intramusculaire.
- Diabète et insuffisance rénale : due à une hypersécrétion de GH (diabète aigu et IR menant à l'apparition d'oedèmes).
- Cancers : du colon et de la prostate chez les hommes acromégales, hépatique, du sein (hyperprolifération mammaire),
RGH
- Syndrôme de Larron : nanisme du à l'absence d"hypothalamus et d'hypophyse, à la mutation des RGH, à l'absence de transduction, à l'absence de dimérisation des récepteurs.

